肿瘤转移的隐匿威胁:休眠癌细胞的觉醒之谜
癌症治疗的核心目标在于彻底清除恶性细胞,但即便在看似成功的治疗后,许多患者仍面临着癌症复发的严峻挑战。其中,肿瘤细胞的转移是导致癌症相关死亡的主要原因。当癌细胞脱离原发肿瘤,迁移至远处器官并长期潜伏,进入一种被称为“休眠”的状态时,它们便如同埋藏的“地雷”,随时可能被触发,导致新的肿瘤形成。乳腺癌患者尤其易受此影响,许多病例在初次治疗数月乃至数十年后,疾病会在完全不同的器官中卷土重来,这无疑给患者带来了巨大的心理和生理负担。
长期以来,科学家们都在探究这些休眠癌细胞为何会突然“苏醒”,重新陷入疯狂的生长和分裂。最近一项发表于《美国国家科学院院刊》(PNAS)的研究,由麻省理工学院和怀特海德生物医学研究所的Robert Weinberg教授及其团队,特别是Jingwei Zhang博士,揭示了一个令人警醒的机制:休眠癌细胞的觉醒并非自发过程,而是由细胞周围的炎症组织所驱动。这一发现为我们理解癌症复发提供了全新的视角,预示着未来在癌症预防和治疗策略上可能发生根本性变革。
癌症转移的漫长旅程:从脱离到潜伏
要深入理解休眠癌细胞的觉醒,首先需要回顾癌细胞转移的复杂过程。癌细胞的首要任务是脱离原发肿瘤。正常细胞之间通过表面蛋白紧密相连,形成稳定的组织结构。然而,某些癌细胞会发生基因突变,干扰这些“分子搭扣”蛋白的产生,使其获得更高的移动性和侵袭性,从而能够摆脱束缚,从原发肿瘤中分离出来。
一旦脱离,它们便能够穿透血管和淋巴管,利用这些通道作为“高速公路”,向远处器官进发。尽管大多数癌细胞在这次“旅程”中会因各种压力而死亡,但少数幸存者会成功离开血液循环,侵入肺、肝、骨甚至大脑等不同组织。在那里,它们可能会建立新的、往往更具侵袭性的肿瘤病灶。
面对陌生的微环境,癌细胞为了生存,常常会进入一种保护性的休眠状态。在这种状态下,细胞停止生长和分裂,变得不可检测,并对常规的癌症治疗产生抵抗。传统的化疗药物往往针对快速分裂的细胞,因此对这些“沉睡”的细胞束手无策,这也解释了为何患者体内残存的休眠细胞成为未来复发的隐患。
炎症:唤醒休眠癌细胞的“信号”
Weinberg实验室的研究团队长期致力于揭示转移的复杂生物学机制。他们的最新研究集中于解答一个核心问题:究竟是什么触发了这些休眠癌细胞的生长和分裂?实验发现,答案在于细胞周围组织受到的炎症刺激。
研究以一种常见的化疗药物——博来霉素(bleomycin)为例。这种药物以其能引起肺组织纤维化和增厚而闻名,常常在手术后用于降低癌症复发风险。令人意外的是,研究显示,博来霉素诱导的肺部炎症足以刺激小鼠体内肺部休眠癌细胞的生长,使其形成大型肿瘤集落。Weinberg教授指出:“炎症会突然惊醒休眠癌细胞。一旦被唤醒,它们就会再次开始增殖,在体内播种新的、危及生命的肿瘤。”
这项发现具有深刻的临床意义。它提示我们,一些看似无害甚至有益的治疗手段,如某些化疗药物,可能在无意中为癌症的未来复发埋下了伏笔。理解这种双重效应,对于优化治疗方案,降低远期复发风险至关重要。这要求临床医生在选择化疗方案时,不仅要考虑其抗肿瘤效果,也要权衡其可能诱导的炎症反应及其对休眠癌细胞的影响。

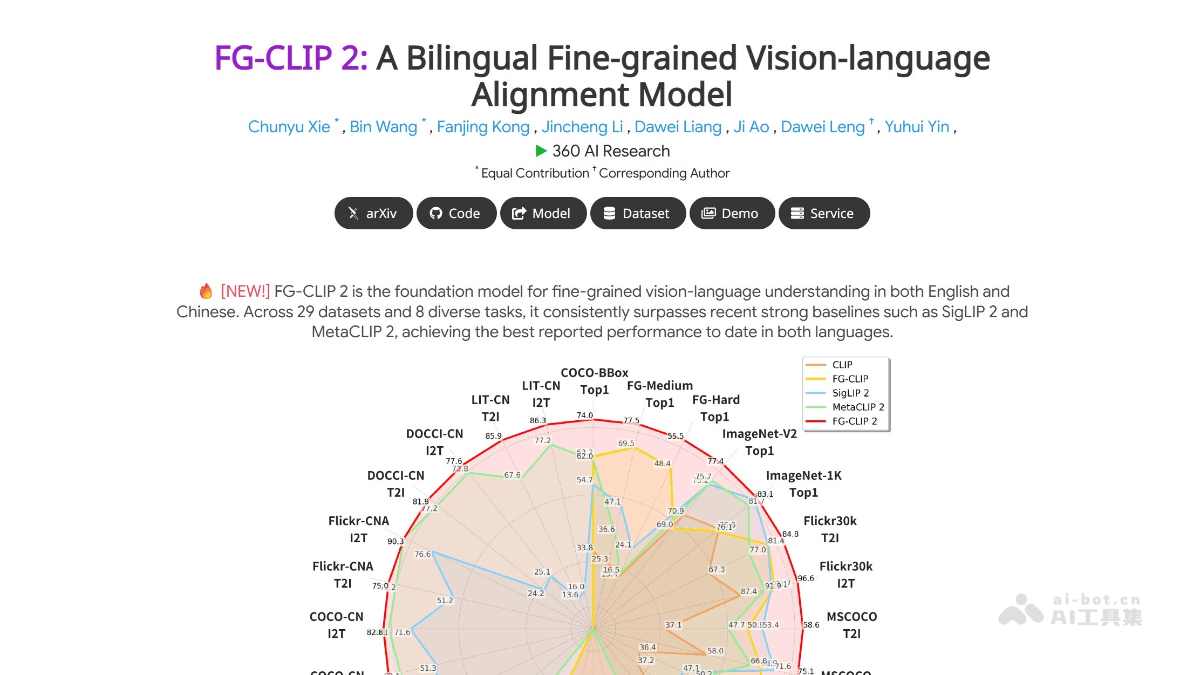
图中可见,红色标记的tdTomato癌细胞在化疗诱导的炎症作用下被唤醒,白色标记的Ki67代表增殖中的细胞。这一图像清晰地展示了炎症对休眠癌细胞活化的影响。
机制剖析:M2巨噬细胞与EGFR信号通路
为了探究休眠细胞可逆转的分子机制,研究人员向小鼠体内注射了经过荧光标记的人类乳腺癌细胞,以便追踪其在体内的行为。他们重点关注了那些已经在肺组织中安家的癌细胞,并利用Ki67、ITGB4和p63等特异性蛋白作为细胞活性和状态的生物标志物,确认这些细胞处于非分裂的休眠状态。
随后,团队通过博来霉素诱导小鼠肺部炎症,观察到炎症确实能显著触发休眠癌细胞的生长,并使其从休眠状态转变为更具侵袭性和迁移能力的表型。深入分析肿瘤微环境,研究人员发现了一种特殊的免疫细胞——M2巨噬细胞,是这一过程的关键驱动者。这些M2巨噬细胞会释放一种名为表皮生长因子受体(EGFR)配体的分子。
EGFR配体与休眠癌细胞表面的受体结合,激活了一系列信号级联反应,从而促使休眠癌细胞迅速增殖。这一发现揭示了炎症微环境与癌细胞之间复杂的相互作用,为开发针对性的干预措施提供了明确的靶点。
“觉醒记忆”:持久的复发风险
更为引人注目的是,研究团队还发现了一个被称为“觉醒记忆”的现象。Zhang博士解释说:“我们发现,一旦休眠癌细胞被唤醒,它们会保留这种‘觉醒记忆’。这意味着它们不再需要微环境中持续的炎症信号来维持活跃状态(生长和增殖)——它们已经记住了被唤醒的状态。”
这种“觉醒记忆”极大地增加了癌症复发的风险,因为它暗示即使炎症消退,被唤醒的癌细胞仍可能继续增殖,形成新的肿瘤。这使得癌症的长期管理变得更加复杂,同时也为未来的治疗策略提出了新的挑战:除了抑制炎症信号,我们是否还需要开发能够“抹去”这种觉醒记忆的药物?
尽管团队已经确定了M2巨噬细胞和EGFR信号在觉醒过程中的关键作用,但觉醒所需的具体信号强度以及完整的信号网络仍不完全明确。Zhang博士指出,癌症生物学中这方面尤其具有挑战性,因为多种信号共同促成了休眠细胞的状态转变。这项复杂而深刻的研究,无疑为未来更全面的癌症机制探索指明了方向。
展望未来:精准抗击转移性癌症
这项研究不仅加深了我们对癌症转移生物学的科学理解,更为转移性癌症患者的治疗带来了希望。识别炎症作为休眠癌细胞的唤醒者,以及M2巨噬细胞和EGFR信号通路的关键作用,为开发新的治疗策略奠定了基础。
未来,我们或许可以通过以下途径来抗击癌症复发:
- 抗炎策略: 开发能够特异性抑制肿瘤微环境中炎症反应的药物,或在使用化疗时同步进行抗炎治疗,以预防休眠癌细胞的觉醒。
- 靶向M2巨噬细胞: 设计药物以调节M2巨噬细胞的功能,减少其释放EGFR配体,从而阻断唤醒信号。
- EGFR信号通路抑制: 针对EGFR及其下游信号通路进行更精准的抑制,防止已被唤醒或即将觉醒的癌细胞增殖。
- “觉醒记忆”的消除: 进一步研究休眠癌细胞如何形成和维持“觉醒记忆”,并探索是否有方法能够逆转或消除这种记忆,从而彻底解除复发风险。
- 化疗方案优化: 根据患者的炎症生物标志物和肿瘤微环境特征,调整化疗药物的选择和组合,以最大程度地减少炎症诱导的复发风险。
癌症治疗正从“一刀切”走向精准化和个体化。理解休眠癌细胞觉醒的分子机制,是攻克转移性癌症的关键一步。虽然仍有诸多未知等待探索,但这项研究无疑开启了一个充满希望的新篇章,激励着科学家们持续努力,为全球癌症患者带来更有效的治疗方案,最终实现对癌症的全面控制。