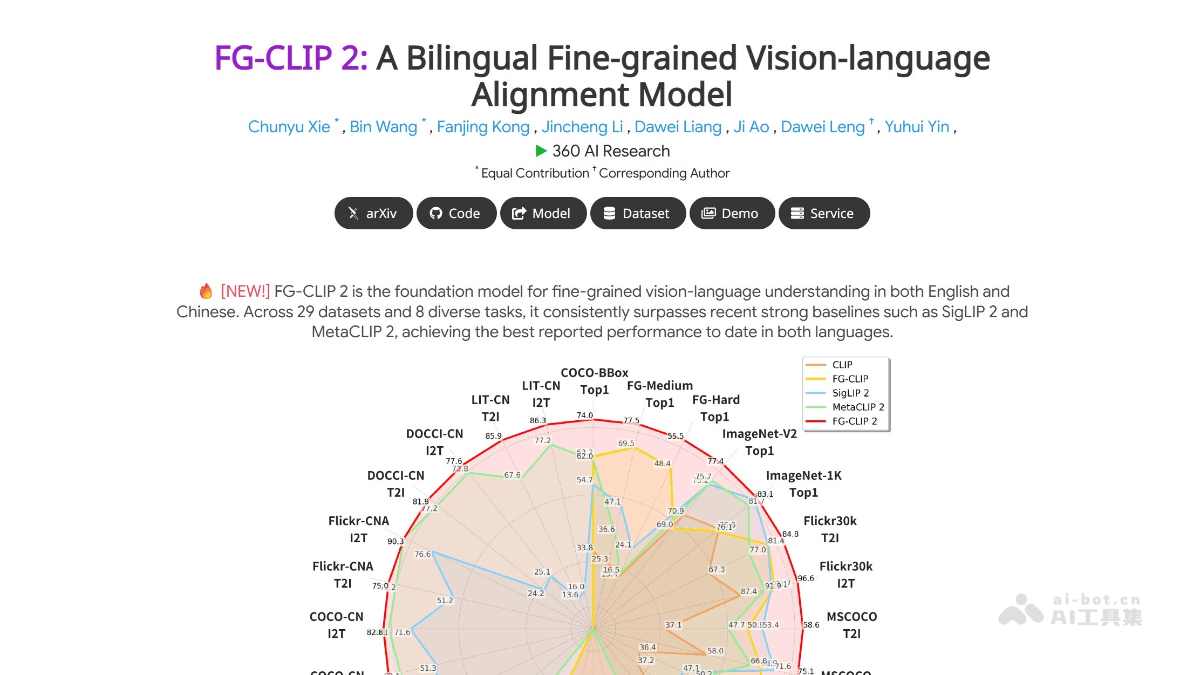
在神经科学和生物医学工程领域,一项突破性研究正在改变我们对大脑疾病的研究方式。麻省理工学院(MIT)的研究团队成功开发出名为"miBrain"(多细胞集成大脑)的3D人类脑组织培养平台,这是首个整合大脑所有六种主要细胞类型的体外系统,为疾病研究和药物开发提供了前所未有的工具。
全新脑模型:miBrain的诞生
miBrain是由诱导多能干细胞(iPSC)培育而成的3D人类脑组织模型,它整合了神经元、胶质细胞和血管系统等所有主要脑细胞类型。每个细胞类型均来自捐赠者的诱导多能干细胞,这使得miBrain能够创建个性化的大脑模型。
"miBrain是唯一包含人类大脑中所有六种主要细胞类型的体外系统,"Picower学习和记忆研究所所长、该研究的资深作者李慧仪(Li-Huei Tsai)教授表示。"在首次应用中,miBrain使我们能够发现阿尔茨海默病最常见的遗传标记之一如何改变细胞相互作用而产生病理。"

miBrain包含六种主要脑细胞类型:周细胞、星形胶质细胞、内皮细胞、神经元、少突胶质细胞和小胶质细胞。每种细胞类型均由诱导多能干细胞独立培养,形成个性化大脑模型。
miBrain的独特优势
结合多种模型优势
miBrain巧妙地结合了不同类型模型的优势,既保留了实验室培养细胞系的便捷性和速度,又能获得更接近人类脑组织复杂生物学的结果。与仅含一两种细胞类型的简单培养不同,miBrain能够模拟大脑中细胞间的复杂相互作用。
与动物模型相比,miBrain避免了物种差异带来的问题,同时降低了成本和实验周期。此外,miBrain源自个体患者,使其能够针对个体基因组进行个性化定制。
模块化设计
miBrain的高度模块化设计是其显著特点,研究人员可以对细胞输入、遗传背景和传感器进行精确控制,这对于疾病建模和药物测试等应用极为有用。每个细胞类型可以单独培养和基因编辑,然后组合形成特定健康或疾病状态的模型。
血脑屏障功能
研究人员确保miBrain具有血脑屏障功能,能够控制哪些物质可以进入大脑,包括大多数传统药物。这一特性使miBrain成为测试药物递送系统的理想平台。
技术突破:克服关键挑战
神经基质设计
设计整合多种细胞类型的模型面临诸多挑战,其中最关键的是找到能够提供细胞物理结构并支持其存活的底物。研究团队从自然组织中细胞周围的环境——细胞外基质(ECM)中获得灵感。
miBrain的基于水凝胶的"神经基质"模仿了大脑的ECM,使用多糖、蛋白聚糖和基底膜的自定义混合物,为大脑所有主要细胞类型提供支架,同时促进功能神经元的发育。
细胞比例优化
第二个关键挑战是确定能形成功能神经血管单元的细胞比例。过去几十年中,细胞类型的实际比例一直存在争议,即使是更先进的方法也只能提供粗略的指导。
研究人员从患者捐赠的诱导多能干细胞开发了六种细胞类型,验证了每种培养的细胞类型都 closely 再现了自然发生的脑细胞。然后,团队通过实验迭代,找到了能形成功能良好的神经血管单元的细胞类型平衡。
阿尔茨海默病研究应用
为了测试miBrain的能力,研究人员研究了APOE4基因变异——阿尔茨海默病最强的遗传预测因子。尽管星形胶质细胞已知是APOE蛋白的主要产生者,但携带APOE4变异的星形胶质细胞在疾病病理中的作用尚不清楚。
miBrain特别适合这项研究,原因有二:首先,它整合了星形胶质细胞与其他脑细胞类型,可以模拟它们与其他细胞的自然相互作用;其次,该平台允许团队单独整合细胞类型,可以在所有其他细胞携带不增加阿尔茨海默病风险的APOE3基因变异的情况下,研究APOE4星形胶质细胞。
关键发现
在实验中,研究人员比较了单独培养的APOE4星形胶质细胞与在miBrain中的APOE4星形胶质细胞。他们发现,只有在miBrain中,星形胶质细胞才表达了与阿尔茨海默病相关的多种免疫反应指标,表明多细胞环境促成了这种状态。
研究人员还跟踪了与阿尔茨海默病相关的淀粉样蛋白和磷酸化tau蛋白,发现所有携带APOE4的miBrain都积累了这些蛋白,而所有携带APOE3的miBrain则没有,正如预期。然而,在带有APOE4星形胶质细胞的APOE3 miBrain中,他们仍然观察到淀粉样蛋白和tau的积累。
细胞相互作用机制
团队深入研究了APOE4星形胶质细胞与其他细胞类型的相互作用如何导致其对疾病病理的贡献。先前的研究已经涉及与大脑小胶质细胞免疫分子的交叉对话。值得注意的是,当研究人员在没有小胶质细胞的情况下培养APOE4 miBrain时,磷酸化tau的产生显著减少。当研究人员将星形胶质细胞和小胶质细胞联合培养的培养基加入APOE4 miBrain时,磷酸化tau增加;而仅加入星形胶质细胞或小胶质细胞单独培养的培养基时,tau产生没有增加。
这些结果提供了新证据,证明小胶质细胞和星形胶质细胞之间的分子对话确实需要磷酸化tau病理的形成。
未来发展方向
研究团队计划为miBrain添加新功能,以更 closely 建模工作大脑的特征,例如利用微流控技术通过血管添加流动,或使用单细胞RNA测序方法改进神经元的分析。
研究人员期望miBrain能够推进阿尔茨海默病及其他疾病的研究发现和治疗方式。
"考虑到其复杂性和模块化,未来有无限的可能性,"Alice Stanton表示。"其中,我们希望利用它来获得对疾病靶点的新见解,治疗疗效的高级读出,以及药物递送载体的优化。"
"我最兴奋的是为不同个体创建个性化miBrain的可能性,"李慧仪补充道。"这有望为个性化医学的发展铺平道路。"
科学意义与影响
miBrain的发明代表了脑组织工程领域的重大突破,它不仅为研究大脑发育和功能提供了新工具,还为理解神经退行性疾病的机制开辟了新途径。通过模拟大脑的复杂细胞相互作用,miBrain能够揭示传统模型无法捕捉的疾病机制,特别是当涉及多种细胞类型之间的对话时。
此外,miBrain的个性化特性使其成为精准医疗的理想平台,可以根据患者的特定基因组特征定制模型,从而预测个体对药物的反应并优化治疗方案。这可能会彻底改变阿尔茨海默病等复杂神经系统疾病的治疗方法。
结语
miBrain的出现标志着神经科学研究进入了一个新时代,它将实验室培养的复杂性与人类生物学真实性相结合,为科学家提供了前所未有的工具来探索大脑的奥秘和疾病的机制。随着技术的不断发展和完善,miBrain有望在基础神经科学、疾病建模、药物筛选和个性化医疗等多个领域产生深远影响,最终造福全球数百万神经系统疾病患者。