突破性发现:细胞记忆的模拟调控机制重塑生物学认知
在生命科学的领域中,细胞身份的稳定性和特异性长期以来被认为是生物体正常发育和功能维持的基石。一个皮肤细胞不会无故转变为脑细胞,反之亦然,这主要归功于表观遗传记忆的强大作用,它使得特定基因的表达模式能够在细胞的整个生命周期中被“锁定”。一旦这种记忆机制发生紊乱,便可能导致癌症等严重疾病的发生。传统观念认为,表观遗传记忆如同一个简单的“开/关”开关,基因要么被完全激活,要么被完全抑制,呈现出一种非此即彼的二元状态。然而,麻省理工学院(MIT)的工程师们通过一项开创性研究,揭示了细胞记忆远比我们想象的更为精妙和复杂,它更像一个可以精确调节的“调光器”。
这项近期发表在《细胞基因组学》(Cell Genomics)上的研究,彻底挑战了关于基因表达调控的传统认知。研究团队通过巧妙的实验设计,在不同细胞中将单个基因的表达水平设定为不同的梯度。按照传统理论,这些基因最终应归结为完全“开启”或完全“关闭”两种状态。然而,出乎意料的是,研究人员观察到基因的初始表达水平得以持续维持:那些被设定在“开启”与“关闭”之间某个中间状态的细胞,其基因表达始终稳定地保持在这一中间水平。这一发现强有力地表明,表观遗传记忆——细胞维持基因表达并“记住”其身份的过程——并非简单的二元选择,而是一个连续的、模拟的机制,允许基因表达及其所关联的细胞身份存在一个广阔的谱系。
颠覆二元论:基因调控的模拟本质
“我们的发现开辟了一种新的可能性,即细胞通过将基因锁定在特定的表达水平而非简单的开或关状态,来确定其最终身份,”该研究的共同作者、麻省理工学院机械与生物工程学教授多米蒂拉·德尔·维奇奥(Domitilla Del Vecchio)指出。“其结果是,我们体内可能存在比目前已知和识别的更多细胞类型,它们可能具有重要的功能,并可能是健康或疾病状态的基础。”这一论断无疑为细胞生物学研究投下了一枚重磅炸弹,预示着未来我们将重新审视和分类细胞类型。
所有细胞都共享相同的基因组,可以将其视为生命起始的蓝图。随着细胞的形成和发育,它通过基因组中特定基因的表达而分化成一种或另一种类型。某些基因被激活,而另一些则被抑制,这种组合最终决定了细胞的独特身份。DNA甲基化过程,即某些分子附着到基因的DNA上,有助于将基因表达锁定到位,从而帮助细胞“记住”其独特的基因表达模式,最终确立细胞的身份。
德尔·维奇奥教授的团队在麻省理工学院致力于运用数学和基因工程方法,深入理解细胞分子过程,并开发具有新功能的工程细胞。在她先前的工作中,团队在卵巢细胞中探索DNA甲基化以及锁定某些基因表达的方法。“教科书上的理解是,DNA甲基化在将基因锁定在开启或关闭状态中发挥作用,”德尔·维奇奥教授回忆道。“我们曾认为这是不容置疑的教条。但随后我们开始看到一些与此不符的结果。”尽管他们实验中的许多细胞表现出基因的“全有或全无”表达,但相当一部分细胞似乎将基因冻结在了一种介于“开启”和“关闭”之间的中间状态。这种不寻常的现象引起了研究团队的极大兴趣。“我们发现,存在一个基因表达水平介于开启和关闭之间的细胞谱系,”该研究的主要作者之一塞巴斯蒂安·帕拉西奥斯(Sebastian Palacios)表示。“我们不禁思考,这怎么可能呢?”
“蓝色调光器”实验:模拟记忆的铁证
为了验证他们观察到的中间基因表达是否仅仅是偶然现象,或者说是否是细胞一个迄今未被注意到的更基本属性,研究团队开展了进一步的深入研究。“科学家们过去可能会忽视那些没有明确身份的细胞,因为他们假设这是一种短暂的状态,”德尔·维奇奥教授解释道。“但实际上,这些处于中间状态的细胞类型可能是永久性的,并可能具有重要功能。”
为了检验这一设想,研究人员利用仓鼠卵巢细胞系进行了一系列实验,这是一种在实验室中常用的细胞模型。在每个细胞中,他们将一个经过基因工程改造的基因设定为不同的初始表达水平。一些细胞中的基因被完全开启,另一些则完全关闭,而剩余细胞中的基因则被设定在开启与关闭之间的某个中间水平。
研究团队将这个工程改造的基因与一个荧光标记物配对,该标记物的亮度与基因的表达水平呈正相关。随后,研究人员短暂引入一种酶,以触发基因的DNA甲基化——这是一种天然的基因锁定机制。接下来,他们对这些细胞进行了长达五个月的监测,以观察这种修饰是否会将基因锁定在它们各自的中间表达水平,或者基因是否会在锁定前逐渐趋向完全开启或关闭的状态。
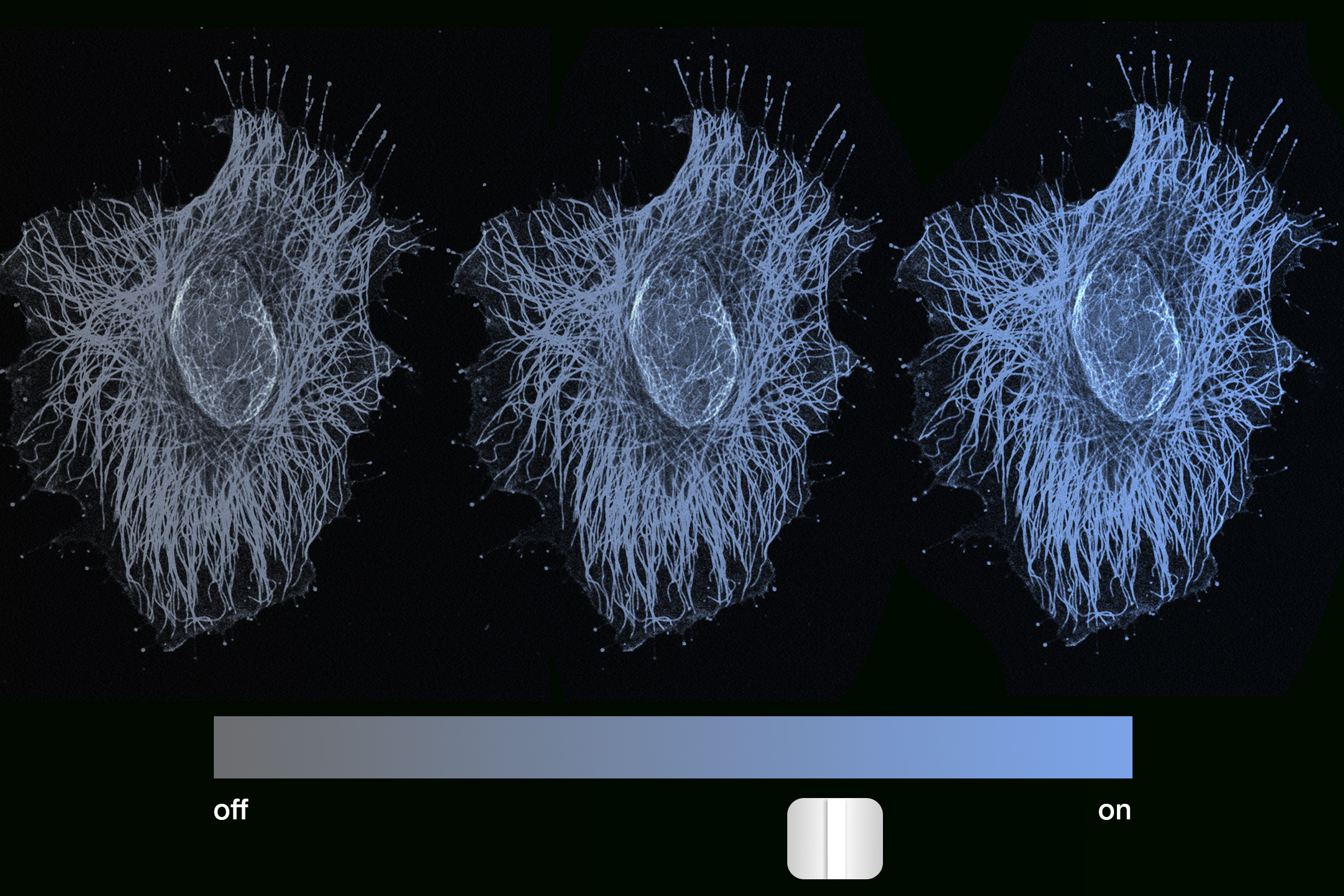 传统上,科学家认为表观遗传记忆将基因锁定为“开启”或“关闭”状态——即完全激活或完全抑制。但麻省理工学院的工程师发现,细胞的记忆不仅通过开关模式设定,还通过基因表达的更具梯度、更像调光器一样的拨盘实现。
传统上,科学家认为表观遗传记忆将基因锁定为“开启”或“关闭”状态——即完全激活或完全抑制。但麻省理工学院的工程师发现,细胞的记忆不仅通过开关模式设定,还通过基因表达的更具梯度、更像调光器一样的拨盘实现。
“我们的荧光标记物是蓝色的,我们看到细胞发出从非常明亮的蓝色到逐渐变暗,直至完全无色的整个光谱,”德尔·维奇奥教授描述道。“每一个强度水平都随着时间的推移而保持稳定,这意味着基因表达是分级的,或者说是模拟的,而非二元的。我们非常惊讶,因为我们原以为在如此长时间后,基因会偏离,要么完全开启要么完全关闭,但它并没有。”这一发现为基因表达的模拟调控提供了直接的实验证据,彻底改变了我们对细胞“记忆”和“身份”的理解。
广阔前景:从组织工程到精准治疗
这些颠覆性的发现为生物工程领域开辟了前所未有的新途径。通过像调节收音机旋钮一样精确调控细胞基因组中特定基因的表达水平,而非仅仅通过开关,科学家们有望工程设计出更加复杂、功能更加强大的人工组织和器官。例如,在再生医学领域,精确控制细胞分化方向和功能特性的能力,将极大地提升类器官和组织替代品的构建精度和效用。
同时,这些研究成果也使我们对细胞表观遗传记忆如何建立其身份的图景变得更加复杂。它提出了一个重要的可能性:细胞中的基因修饰,例如那些在具有治疗抵抗性的肿瘤中表现出来的修饰,可能可以通过一种更为精确、细致的方式进行治疗干预。如果肿瘤细胞的恶性表型并非完全由“开/关”决定,而是由某种“调光”机制导致,那么未来的药物研发便可针对这些中间状态进行精准调节,而非仅仅尝试完全抑制或激活。
加州理工学院生物与生物工程学教授迈克尔·埃洛维茨(Michael Elowitz),尽管未参与此项研究,但高度评价道:“德尔·维奇奥及其同事们精彩地展示了模拟记忆是如何通过DNA本身的化学修饰产生的。因此,我们现在可以设想在合成生物学领域重新利用这种由进化所创造的天然模拟记忆机制,这将有助于我们编程永久且精确的多细胞行为。”
帕拉西奥斯也补充说:“人类复杂性的一个重要支撑就是表观遗传记忆。我们现在发现它并非我们曾经认为的那样。对我来说,这确实是令人兴奋的突破。我相信,这种模拟记忆将在生物学的许多不同过程中都显示出其关联性。”这项研究的深远影响不仅在于修正了我们对基因调控基本原理的认识,更在于其为未来生物医学研究和应用提供了全新的理论框架和技术路线,推动了从基础科学到临床实践的范式转变。


